Публикации
Мы представляем полный текст статьи «Экспрессия факторов дифференцировки CD44, CD29 и остекальцина в альвеолярной кости при накостной фиксации свободного десневого трансплантата» опубликованной в Российском стоматологическом журнале, 2020; Т. 24, N. 3.
Пожалуй, ни для кого не секрет, что «золотым стандартом» для мягкотканных пластических операций полости рта является использование СДТ из мягких тканей твёрдого нёба. Выяснением молекулярно-клеточных факторов и механизмов репаративного воздействия на ткани полости рта занимается группа учёных – Сергей Сергеевич Едранов, Наталья Юрьевна Матвеева и Сергей Георгиевич Калиниченко, в рамках утверждённого научного направления «Исследование молекулярных факторов регенерации слизистой оболочки и кости при экспериментальном моделировании атрофии зубо-челюстного сегмента и установки имплантатов», под руководством Едранова С.С.

Обоснование
Актуальной задачей дентальной имплантологии является выяснение молекулярно-клеточных факторов и механизмов репаративного воздействия на ткани полости рта [1−3].
Формирование десневой манжеты с плотным прикреплением вокруг имплантата в значительной степени определяется объемом костной ткани и регенераторным потенциалом десны и нёба. Поскольку имплантация может проводиться в зоне атрофии твердых и мягких тканей, в большинстве случаев в области установленного имплантата имеется подвижная слизистая оболочка, и костно-пластические манипуляции делают ее еще менее стабильной [4−6]. Подвижная слизистая оболочка менее устойчива к механическим нагрузкам, способствует рецессии мягких тканей в области имплантатов, ускоряет убыль костной ткани [2, 7] и приводит к возникновению периимплантита [8].
«Золотым стандартом» для мягкотканных пластических операций полости рта является использование свободного десневого трансплантата (СДТ) из мягких тканей твердого нёба [9−11]. Однако среди побочных эффектов СДТ отмечается индукция образования альвеолярной кости [12]. До настоящего времени возможность подобных остеогенных модификаций остается дискуссионной. Неизвестно также участие ростовых факторов и трофических молекул в регуляции этих процессов. Динамическое изменение альвеолярной костной ткани зависит от микросреды, которую определяют, прежде всего, васкуляризация и наличие мезенхимальных стволовых клеток (МСК) [13, 14]. МСК индуцируют пролиферацию и дифференцировку, синтезируя цитокины и факторы роста, и вызывают синергетический ответ соседних клеток [15]. Молекулы межклеточной сигнализации — костные морфогенетические белки (bone morphogenetic proteins, BMP), факторы роста фибробластов (fibroblast growth factor, FGF), транскрипционные факторы MSX 1 и 2 — индуцируют экспрессию генов в МСК и способствуют их детерминации и дифференцировке в остеобласты [16, 17]. Источником МСК и генно-модифицирующих факторов может являться СДТ, соединительная ткань которого богата малодифференцированными клеточными элементами с пролиферативной активностью и остеогенным потенциалом, способными формировать новую кость.
Цель работы — исследовать локализацию стволовых стромальных клеток на поверхности свободного десневого трансплантата.
Материал и методы
В эксперименте воспроизводилась накостная фиксация свободного десневого трансплантата.
Работа выполнена на шести беспородных миниатюрных свиньях-самцах в возрасте 2 лет, весом 30 кг.
Оперативное вмешательство осуществляли в асептических условиях под комбинированным наркозом (пропофол внутривенно, золетил внутримышечно, изофлуран ингаляционно). После обработки операционного поля производили разрез кожи и подкожной клетчатки от подбородка до угла челюсти, затем послойное рассечение тканей до нижнего края нижней челюсти. С наружной стороны челюсти надкостница иссекалась на всю площадь фиксации свободного десневого трансплантата. Свободный десневой трансплантат фиксировался соединительнотканной поверхностью непосредственно на кортикальную пластинку ближе к краю нижней челюсти. Фиксация проводилась костными кнопками (пинами) длиной 3−4 мм. Для контроля положения фиксированного трансплантата на этапе взятия экспериментального материала через 4−6 мес рядом с самим трансплантатном фиксировалась восьмисекционная мини-плата с отверстиями под двухмиллиметровые винты. Рана послойно ушивалась рассасывающимся шовным материалом и обрабатывалась антисептиком. Для визуализации и контроля положения мини-платы (и, соответственно, свободного десневого трансплантата) использовали метод компьютерной томографии с помощью компьютерного томографа GE Optima CT520.
Иммуноцитохимическое исследование
Материал фиксировали в 4% параформальдегиде на фосфатном буфере в течение 24 ч, после чего промывали 0,1 М Na-фосфатном буфере (рН 7,2) с 6−7-кратной сменой раствора. Декальцинацию проводили в 25% растворе трилона Б (pH 7,0) при комнатной температуре на аппарате Orbital Shaker OS-20 Biosan. После декальцинации образцы промывали и заливали в парафин по общепринятой методике. Срезы толщиной 15 мкм монтировали на предметные стекла, депарафинировали и инкубировали в 3% растворе перекиси водорода для блокирования эндогенных пероксидаз в течение 15 мин. После трех промывок 0,1 М Naфосфатном буфером (рН 7,2) срезы обрабатывали в течение 1 ч в 2% растворе бычьего сывороточного альбумина и 0,25% Тритона Х-100. Затем инкубировали с первичными антителами (АТ). Для этой цели использовали мышиные моноклональные АТ против остеокальцина [OCG3] (Abcam, Великобритания) в разведении 10 мг/мл, кроличьи поликлональные АТ против CD44 в разведении 1 : 500 (Abcam, Великобритания) и мышиные моноклональные АТ против CD29 (интегрин-бета-1) (Abcam, Великобритания) в разведении 1 : 100. Первичные АТ разводили в фосфатном буфере, содержащем Тритон Х-100 и бычий сывороточный альбумин, и инкубировали в течение ночи при температуре 4 °С. После промывки срезы в течение 1 ч инкубировали в растворе биотинилированных вторичных антител против иммуноглобулина кролика и мыши соответственно первичным АТ, которые разводили в соответствии с инструкциями фирмы-производителя (Abcam, Великобритания). После отмывки вторичных антител препараты инкубировали в растворе авидин-пероксидазного комплекса (Abcam, Великобритания). Срезы выдерживали в растворе диаминобензидина (DAB Substrate Kit, Abcam, Великобритания) в течение 4 мин, затем промывали, обезвоживали и заключали в бальзам по обычным правилам. В качестве контроля из среды исключали первичные АТ, окрашивание клеток отсутствовало. Часть срезов окрашивали гематоксилином и эозином.
Препараты просматривали в световом микроскопе AxioScope A1 (Carl Zeiss, Германия) и фотографировали при помощи цифровой камеры AxioCam ICc3.
Этическая экспертиза
Условия содержания животных, а также экспериментальные условия соответствовали директиве 2010/63/EU Европейского союза 2010 г., определяющей правила научных экспериментов над животными. Эксперимент одобрен Междисциплинарным комитетом по этике ФГБОУ ВО ТГМУ Минздрава России, протокол № 9 от 06.05.2019 г.
Статистический анализ
Морфометрическую обработку полученных фотографий проводили при помощи пакета программ AxioVision 4.8.1. Относительную плотность клеток вычисляли в единице объема (из расчета на 0,01 мм2 ) костного вещества с учетом поправки на толщину среза и диаметр ядра. Данные обрабатывали методом вариационной статистики с определением t-критерия достоверности по Стьюденту (р < 0,05).
Результаты
На третьем месяце послеоперационного периода в области контакта альвеолярного отростка и СДТ наблюдается формирование новой компактной кости, имеющей характерные морфологические признаки. К ним относятся параллельно уложенные костные пластинки, формирующие прерывистый поверхностный слой и остеоны различной толщины. На поверхности пластинчатой кости выявляются участки грубоволокнистой ткани с хаотичным сплетением коллагеновых волокон.
При окрашивании гематоксилином и эозином в новообразованной компактной кости на поверхности трансплантата встречаются резко базофильные клетки на фоне оксифильного межклеточного вещества общих пластин. Они имею крупный размер (21 ± 1,8 мкм), овальную или призматическую форму и эксцентричное ядро. По совокупности этих признаков их можно идентифицировать как остеобласты. По ходу пластин остеобласты образуют разновеликие скопления округлой и дугообразной формы или в виде длинных тяжей (рис. 1). Их принадлежность к остеогенному дифферону подтверждается экспрессией остеокальцина, специфического маркера поздней стадии дифференцировки остеобластов.
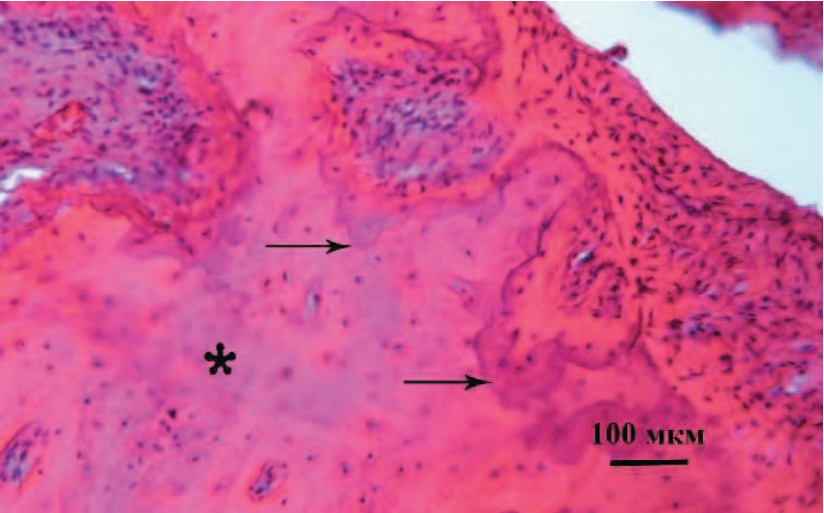
Рис. 1. Новообразованная компактная кость в области контакта СДТ нижней челюсти миниатюрной свиньи.
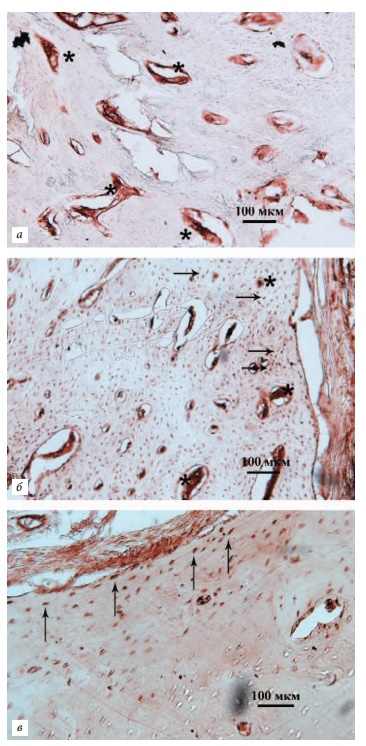
Рис. 2. Локализация CD29, CD44 и остеокальцина в костной ткани нижней челюсти беспородной миниатюрной свиньи в области контакта СДТ при накостной фиксации свободного десневого трансплантата. Третий месяц послеоперационного периода.
а — CD29-иммунопозитивные клетки рыхлой волокнистой ткани гаверсовых каналов формирующихся остеонов (звездочки); б — CD44-иммунореактивные клетки остеобластического дифферона (стрелки) между костными пластинками и толстом слое рыхлой соединительной ткани гаверсовых каналов во вновь сформированных остеонах; в — остеокальцин-позитивные остеоциты в слое наружных генеральных пластин, прилегающих к собственной пластинке
На границе расположения новообразованной кости и собственной пластинки десны определяются участки с незамкнутыми костными пластинками в виде округлой, полулунной или разветвленной полости. С их внутренней стороны отмечается скопление стромальных клеток, экспрессирующих CD29 и CD44. Часть этих клеток может выступать за границы лакуны и в виде лентообразных скоплений простираться до остеонов. Также в слое общих пластин мы наблюдали CD44- и остеокальцинпозитивные клетки, имеющие морфологические признаки остеоцитов. Иммунореактивные веретеновидные клетки распределялись неравномерно, формируя отдельные скопления в виде узкой ленты, преимущественно в зоне прободающих коллагеновых волокон со стороны собственной пластинки.
Вся толща костной ткани, находящейся в непосредственной анатомической близости к трансплантату, включает остеоны, вставочные костные пластинки, систему анастомозирующих гаверсовых и фолькмановых каналов с сосудистым компонентом. Среди остеонов можно четко выделить молодые формирующиеся остеоны новой кости и зрелые костные структуры. Диаметр молодых остеонов округлой, овальной или треугольной формы в среднем составляет 225,1 ± 12,3 мкм, количество костных пластин в них варьирует от 3 до 5. Между костными пластинами в лакунах равномерно распределяются остеоциты, клетки веретеновидной формы, с овальным ядром, слабобазофильной цитоплазмой, размером 32,7 ± 2,5 мкм. Каждый остеон окружен хорошо выраженной линией склеивания — базофильным слоем бесклеточного аморфного вещества. Костные пластинки ориентированы циркулярно вокруг центрально расположенного гаверсова канала, средний диаметр его составляет 49,3 ± 4,2 мкм. Полость гаверсова канала выстлана широким слоем тонковолокнистой рыхлой соединительной ткани с клеточными элементами, среди которых наблюдается высокая иммунореактивность CD29, CD44 и остеокальцина (рис. 2, а, б). Такая же высокая экспрессия маркеров отмечается в лакунарных остеоцитах на поверхности костных пластин, непосредственно окружающих канал и прилегающих к собственной пластинке (рис. 2, в). Лакуны преимущественно овальной формы, длиной 36,3 ± 2,8 мкм. В остеонах они ориентированы вдоль костных пластин, тогда как в слое общих и вставочных пластин отмечается хаотичное расположение. Часто обнаруживаются прободающие фолькмановы каналы, анастомозирующие с гаверсовыми, благодаря чему создаются условия для значительного кровоснабжения формирующейся новой кости. Зрелая кость окрашена однородно, слабооксифильно и представлена параллельными общими костными пластинами и зрелыми покоящимися остеонами. Эти остеоны имеют больший диаметр — до 315,2 ± 11,2 мкм, 5–7 параллельных пластин ориентированы также циркулярно, однако узкий гаверсов канал (средний диаметр 21,3 ± 3,1 мкм) часто смещен в сторону. Рыхлая волокнистая соединительная ткань тонким слоем выстилает полость канала; CD29-, CD44- и остеокальцинпозитивные клетки здесь практически отсутствуют. Лакуны с остеоцитами имеют вид уплощенного эллипса длиной 43,1 ± 3,3 мкм, располагаются правильными параллельными рядами и в остеонах, и в общих и вставочных пластинах.
Обсуждение
В настоящей работе впервые установлены феномен неоостеогенеза и участие мезенхимальных стволовых клеток в организации этого процесса при установке СДТ. Использованная нами модель СДТ является адекватной при исследовании иммобилизации трансплантата в реципиентной зоне для определения динамики регенераторного процесса на границе тансплантат-ложе. Миниатюрные свиньи часто используются в качестве модели в стоматологических исследованиях из-за схожего с людьми гетеродонтного зубного ряда с резцами и молярами, только немного большего размера [17]. Этапы развития и схожие паттерны прорезывания подтверждают их пригодность в качестве модели животных для стоматологии [18, 19].
Репаративный остеогенез и физиологическая регенерация кости зависят от многих факторов, среди которых преобладающими признаны сосудистое обеспечение, факторы роста и индукция стволовых клеток [20]. Нет сомнения, что они функционируют взаимосвязано и оказывают на растущую кость комплексное воздействие.
Первым ответом ткани реципиента на ткань донора является локальное воспаление в собственной пластинке слизистой оболочки десны. Фибробласты и лейкоциты, поддерживающие это воспаление, активно выделяют факторы, способствующие миграции и пролиферации эндотелия, формированию новой базальной мембраны и росту капилляров [21]. В регуляции ангиогенеза, пролиферации и дифференцировке участвуют фактор роста эндотелия сосудов (vascular endothelial growth factor, VEGF), фактор роста фибробластов бета (fibroblast growth factor beta, FGF-β), суперсемейство трансформирующего фактора роста бета (transforming growth factor beta, TGF-β), фактор некроза опухоли альфа (tumor necrosis factor alpha, TNF-α) [8, 22]. Все они являются полифункциональными и, помимо ангиогенеза, формируют соответствующее микроокружение для дифференцировки стромальных стволовых клеток в остеогенные.
Фаза дифференцировки клеток-предшественников в остеобласты происходит на поверхности вновь образованного костного матрикса при регулирующем воздействии факторов роста и костных морфогенетических белков ВМР-2 и ВМР-7 [23, 24].
В наших экспериментах индукция остеогенеза достигается формированием тесных взаимосвязей между тканью трансплантата и тканью альвеолярного отростка. Основными участниками этого процесса являются МСК, которые могут поступать сюда из самого трансплантата либо выселяться из общего кровотока в период постоперационной регенерации нижней или верхней челюсти [25].
Обнаруженные нами маркеры стволовых клеток CD29, CD44 и остеокальцин экспрессируются на разных стадиях дифференцировки остеобластов. CD44 экспрессируются недифференцированными МСК и характеризуют первую стадию регенерации, сопровождающуюся активной пролиферацией клеточных элементов [26]. Детерминированные МСК с остеогенным потенциалом маркируются CD29 (integrin β-1). Остеокальцин же экспрессируется остеобластами, находящимися на поздней стадии дифференцировки, и характеризует начало формирования новой кости [20, 27]. Кроме того, CD44 и CD29 являются поверхностными рецепторами, посредством которых белки межклеточного матрикса реализуют свои регуляторные эффекты [25, 26].
Клетки, экспрессирующие CD29, CD44 и остеокальцин, обнаруживаются на границе новообразованной кости и собственной пластинки альвеолярного отростка, в зоне общих пластин, на поверхности костных пластин молодых остеонов, окружающих гаверсов канал, и в его полости, находящихся в непосредственной близости к трансплантату. Это позволяет предположить индуцирующую роль в неоостеогенезе СДТ твердого нёба, включающего МСК собственной пластинки слизистой оболочки и подслизистой основы. Трансплантат выступает как источник трофических и ростовых молекул, формирующих благоприятный метаболический фон для стимуляции пролиферации и дифференцировки МСК реципиента [12, 28]. Сигналы для образования новой кости могут поступать и из ткани нёба. СДТ является источником миграции камбиальных клеток-предшественников остеобластов по крайней мере из двух мест — прогенеторных клеток канала остеона и мягких тканей самого твердого нёба. Нёбо отличается высокой концентрацией стволовых предшественников, что усиливает его остеогенные свойства [29, 30].
В условиях активной клеточной пролиферации стромальных клеток вокруг экзогенных имплантатов и/или трансплантатов происходит формирование новых сосудов, что предполагает существование молекулярных взаимодействий между эндотелием и остеобластическими клетками [20]. Кровеносные сосуды опосредуют миграцию МСК и трофических факторов, поддерживают периваскулярные остеопрогениторные клетки и обеспечивают метаболическую специализированную тканевую среду, необходимую для формирования новой кости.
Заключение
Накостная фиксация СДТ ремоделирует альвеолярную кость, которая проявляет признаки репаративного процесса. Наличие экспрессии CD29 и CD44 в тканях кости указывает на активацию мезенхимальных камбиальных клеток, которые дифференцируются в остеокальцинсодержащие остеобласты. Индуцирующая роль свободного десневого трансплантата в формировании новой кости определяется способностью его клеток синтезировать трофические факторы, стимулирующие рост сосудов пролиферацию и дифференцировку МСК. Модель на миниатюрных свиньях является полезным инструментом для изучения этого процесса.
Авторы: Едранов С.С., Матвеева Н.Ю., Калиниченко С.Г
Финансирование: исследование не имело спонсорской поддержки.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
1. Едранов С.С. Клеточно-молекулярные аспекты посттравматической регенерации слизистой оболочки околоносовых пазух. Тихоокеанский медицинский журнал. 2016;(2):67–71.
2. Souza A.B., Tormena M., Matarazzo F., Araújo M.G. The influence of peri-implant keratinized mucosa on brushing discomfort and peri-implant tissue health. Clin Oral Implants Res. 2016;27(6):650–5. doi: 10.1111/clr.13381.
3. Hatzimanolakis P., Tsourounakis I., Kelekis-Cholakis A. Dental implant maintenance for the oral healthcare team. Compend Contin Educ Dent. 2019;40(7):424–9. 4. Brito C., Tenenbaum H.C., Wong B.K., Schmitt C., Nogueira-Filho G. Is keratinized mucosa indispensable to maintain peri-implant health? A systematic review of the literature. J. Biomed. Mater. Res. Part B Appl. Biomater. 2014;102(3):643–50. doi: 10.1002/ jbm.b.33042.
5. Ladwein C., Schmelzeisen R., Nelson K., Fluegge T.V., Fretwurst T. Is the presence of keratinized mucosa associated with periimplant tissue health? A clinical cross-sectional analysis. Int J Implant Dent. 2015;1(1):11. doi: 10.1186/s40729–015-0009-z.
6. Roccuzzo M., Grasso G., Dalmasso P. Keratinized mucosa around implants in partially edentulous posterior mandible: 10-year results of a prospective comparative study. Clin Oral Impl Res. 2016;27(4):491–6. doi: 10.1111/clr.12563.
7. Puisys A., Linkevicius T. The influence of mucosal tissue thickening on crestal bone stability around bone-level implants. A prospective controlled clinical trial. Clin Oral lmpl Res. 2015;26(2):123–9. doi: 10.1111/clr.12301.
8. Monje A., Galindo-Moreno P., Tözürm T.F., Suárez-López del Amo F., Wang H.L. Into the paradigm of local factors as contributors for periimplant disease: a short communication. J Oral Maxillofac Impl. 2016;31(2):288–92. doi: 10.11607/jomi.4265.
9. Barboza E.P., Stutz B., Mandarino D., Rodrigues D.M., Ferreira V.F. Evaluation of a dense polytetrafluoroethylene membrane to increase keratinized tissue: a randomized controlled clinical trial. Implant Dent. 2014;23(3):289–94. doi: 10.1097/ID.0000000000000060.
10. Rojo L., Deb S. Polymer therapeutics in relation to dentistry. Front Oral Biol. 2015;17:13–22. doi: 10.1159/000381688.
11. Cheon G.B., Kang K.L., Yoo M.K., Yu J.A., Lee D.W. Alveolar ridge preservation using allografts and dense polytetrafluoroethylene membranes with open membrane technique in unhealthy extraction socket. J Oral Implantol. 2017;43(4):267–73. doi: 10.1563/aaid-joi-D17–00012.
12. Едранов С.С., Керзиков Р.А. Морфогенез свободного десневого трансплантата. Российский стоматологический журнал. 2017;21(2):111–6.
13. Sharpe P.T. Dental mesenchymal stem cells. Development. 2016;143:2273–80. doi: 10.1242/dev.134189.
14. Aydin S., Şahin F. Stem cells derived from dental tissues. Adv. Exp. Med. Biol. 2019;1144:123–32. doi: 10.1007/5584–2018-333.
15. TrubianiO., Orsini G., Caputi S., Piatelli A. Adult mesenchymal stem cells in dental research: a new approach for tissue engineering. Int J Immunopathol Pharmacol. 2006;19(3):451–60. doi: 10.1177/ 039463200601900301.
16. Dave J.R., Tomar G.B. Dental tissue-derived mesenchymal stem cells: applications in tissue engineering. Crit Rev Biomed Eng. 2018;46(5):429–68. doi: 10.1615/CritRevBiomedEng.2018027342.
17. Wang X., Wang Y., Gou W., Lu Q., Peng J., Lu S. Role of mesenchymal stem cells in bone regeneration and fracture repair: a review. Int Orthop. 2013;37(12):2491–8. doi: 10.1007/s00264–013-2059–2.
18. Капанадзе Г.Д. Использование миниатюрных свиней в биомедицинских экспериментах. Биомедицина. 2006;(2):40–51.
19. Wang S., Liu Y., Fang D., Shi S. The miniature pig: a useful large animal model for dental and orofacial research. Oral Dis. 2007;13(6):530–7. doi: 10.1111/j.1601–0825.2006.01337.x.
20. Borges T., Fernandes D., Almeida B., Pereira M., Martins D., Azevedo L., Marques T. Correlation between alveolar bone morphology and volumetric dimensional changes in immediate maxillary implant placement: a 1-year prospective cohort study. J Periodontol. 2020; doi: 10.1002/JPER.19–0606.
21. Fournier B.P., Ferre F.C., Couty L., Lataillade J.J., Gourven M., Naveau A. et al. Multipotent progenitor cells in gingival connective tissue. Tissue Eng Part A. 2010;16(9):2891–9. doi: 10.1089/ ten.TEA.2009.0796.
22. Калиниченко С.Г., Матвеева Н.Ю., Костив Р.Е., Пузь А.В. Сосудистый эндотелиальный фактор роста и трансформирующий фактор роста-b2 в костной ткани крыс при установке после перелома титановых имплантатов с биоактивными биорезорбируемыми покрытиями. Бюллетень экспериментальной биологии и медицины. 2016;162(11):626–31.
23. Костив Р.Е., Калиниченко С.Г., Матвеева Н.Ю. Трофические факторы роста костной ткани, их морфогенетическая характеристика и клиническое значение. Тихоокеанский медицинский журнал. 2017;(1):10–6.
24. Матвеева Н.Ю., Костив Р.Е., Калиниченко С.Г., Пузь А.В., Плехова Н.Г. Динамика регенерации перелома бедренной кости крыс с применением титанового имплантата с поверхностно активным покрытием. Международный журнал прикладных и фундаментальных исследований. 2015;(10–5):849–53.
25. Плехова Н.Г., Ляпун И.Н., Калиниченко С.Г., Матвеева Н.Ю., Костив Р.Е., Гнеденков С.В., и др. Влияние биоинертных и биорезорбируемых металлических имплантатов на экспрессию мембранных рецепторов дендритных клеток. Современные проблемы науки и образования. 2015;(5):181.
26. Grawish M.E. Gingival-derived mesenchymal stem cells: An endless resource for regenerative dentistry. World J Stem Cells. 2018;10(9):116–8. doi: 10.4252/wjsc.v10.i9.116.
27. Franchi M., Orsini E., Trirè A., Quaranta, M., Martini D., Piccari G.G. et al. Osteogenesis and morphology of the peri-implant bone facing dental implants. Scientific World Journal. 2004;4:1083–95. doi: 10.1100/tsw.2004.211.
28. Kalinichenko S.G., Matveeva N.Yu., Kostiv R.Ye, Edranov S.S. The topography and proliferative activity of cells immunoreactive to various growth factors in rat femoral bone tissues after experimental fracture and implantation of titanium implants with bioactive biodegradable coatings. Biomed Mater Eng. 2019;30(1):85–95. doi: 10.3233/BME-181035.
29. Kantarci A., Hasturk H., Van Dyke T.E. Animal models for periodontal regeneration and peri-implant responses. Periodontol 2000. 2015;68(1):66–82. doi: 10.1111/prd.12052.
30. Iorio-Siciliano V., Blasi A., Sammartino G., Salvi G.E., Sculean A. Soft tissue stability related to mucosal recession at dental implants: a systematic review. Quintessence Int. 2020;51(1):28–36. doi: 10.3290/ j.qi.a43048.